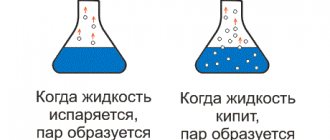
Как происходит процесс кипения воды?
Кипение воды является сложным процессом, который происходит в четыре стадии. Рассмотрим пример кипения воды в открытом стеклянном сосуде.
На первой стадии кипения воды на дне сосуда появляются небольшие пузырьки воздуха, которые также можно заметить и на поверхности воды по бокам.
Эти пузырьки образуются в результате расширения небольших пузырей воздуха, которые находятся в мелких трещинах сосуда.
На третьей стадии на поверхность воды поднимается огромное количество пузырьков, что вначале вызывает небольшое помутнение воды, которая затем «бледнеет». Данный процесс продолжается недолго и имеет название «кипение белым ключом».
Наконец, на четвертой стадии кипения вода начинает интенсивно бурлить, появляются большие лопающиеся пузыри и брызги (как правило, брызги означают, что вода сильно перекипела).
Из воды начинает образовываться водяной пар, при этом вода издает специфические звуки.
Почему «цветут» стены и «плачут» окна? Очень часто в этом виноваты строители, неправильно рассчитавшие точку росы. Читайте статью Точка росы: определение чтобы узнать, насколько это важное физическое явление, и как все-таки избавиться от излишней сырости в доме?
Какую пользу может принести талая вода для желающего похудеть? Об этом вы узнаете прямо тут, оказывается, худеть можно без особых усилий!
Стадии кипячения воды
Выделяется три стадии:
- Первоначальное кипение. Кинетирование жидкости характеризуется ростом количества пузырьков на нагретой поверхности, поднимающихся из дискретных точек, температура которых лишь немного выше жидкостной. Неправильная поверхность емкости может создавать дополнительные места зарождения пузырьков, в то время как исключительно гладкая поверхность, такая как пластик, поддается перегреву. В этих условиях нагретая вода может показывать задержку кипения и температура несколько превышает температуру кипения без образования пузырьков.
- Критический тепловой поток. Когда температура поднимается выше критической, на поверхности образуется пар. Поскольку эта паровая пленка гораздо менее способна переносить тепло от поверхности, температура быстро возрастает, жидкость переходит в режим кипения. Точка, в которой это происходит, зависит от характеристик кипящей воды и рассматриваемой поверхности нагрева.
- Переходное состояние. Переходное состояние можно определить как нестабильное кипение, которое происходит на поверхности. Образование пузырьков в нагретой воде представляет собой сложный физический процесс, который часто включает кавитационные и акустические эффекты, такие как шипение широкого спектра, слышимое в чайнике или другой емкости, еще не нагретой до того момента, когда появятся пузырьки.
Если поверхностное нагревание жидкости значительно сильнее, чем внутри нее, тогда тонкий слой пара, который имеет низкую теплопроводность, изолирует поверхность. Это состояние паровой пленки, изолирующей поверхность от жидкости, характеризует кипение пленки.
Температура пара при кипении воды
Пар – это газообразное состояние воды. Когда пар поступает в воздух, то он, как и другие газы, оказывает на него определенное давление.
В процессе парообразования величина температуры пара и воды будет оставаться постоянной до тех пор, пока не испарится вся вода. Такое явление объясняется тем, что вся энергия (температура) направлена на превращение воды в пар.
В данном случае образуется сухой насыщенный пар. Высокодисперсные частицы жидкой фазы в таком паре отсутствуют. Также пар может быть насыщенным влажным и перегретым.
[wpmfc_short code=»Block2"]
Насыщенный пар с содержанием взвешенных высокодисперсных частиц жидкой фазы, которые равномерно распределены по всей массе пара, называется влажным насыщенным паром.
В начале закипания воды образуется именно такой пар, который затем переходит в сухой насыщенный. Пар, температура которого больше температуры кипящей воды, а точнее перегретый пар, можно получить только с использованием специального оборудования. При этом такой пар будет близок по своим характеристикам к газу.
Процессы кипения и конденсации на графиках
Пусть небольшое количество воды находится в просторном закупоренном сосуде.
Разберем, как выглядят на температурных графиках процессы кипения и конденсации. Для начала рассмотрим график нагревания и кипения (рис. 3).
Вначале вода имела температуру +20 градусов Цельсия. Будем нагревать эту воду. Поначалу ее температура будет расти. На графике это показано наклонной синей линией, находящейся в левой части рисунка.
Рис. 3. График нагревания воды, ее кипения и нагревания полученного пара
До бесконечности температура подниматься не будет. Как только температура достигнет некоторого предела, вода закипит. Из рисунка следует, когда температура воды достигла отметки +100 градусов Цельсия и начался процесс кипения. Этот процесс на рисунке схематично обозначен горизонтальной красной линией.
Горизонтальное положение линии кипения означает, что во время кипения температура воды не изменяется. Температура будет оставаться неизменной до тех пор, пока вся вода не превратится в газообразное состояние — пар. Для компактности рисунка я укоротил эту линию, на самом деле, длину этой линии нужно увеличить.
Уже после того, как вся вода превратилась в пар, температура пара начала повышаться. Это изображено на рисунке наклонной синей линией, находящейся правее красной линии.
Будем теперь отбирать тепловую энергию у молекул. Предположим, что мы охлаждаем горячий водяной пар, находящийся в закупоренном сосуде. Процессы его охлаждения и конденсации представлены на графике (рис. 4). Этот график можно получить, зеркально отразив вокруг вертикальной оси график, связанный с нагреванием, рассмотренный ранее.
Рис. 4. График охлаждения пара, его конденсации и охлаждения полученной воды
Из графика следует:
Вначале температура пара уменьшается от +180 градусов Цельсия до +100 градусов. Это наклонная синяя линия, расположенная в левой части рисунка.
Затем, происходит конденсация пара. Молекулы пара собираются в капли жидкости. При этом, температура пара не изменяется и остается равной +100 градусам Цельсия.
Как только весь пар конденсируется, образовавшаяся жидкая вода начинает охлаждаться до конечной температуры + 20 градусов Цельсия. На графике охлаждение воды – это синяя наклонная линия, находящаяся справа от красной линии конденсации.
Температура кипения соленой воды
Температура кипения соленой воды превышает температуру кипения пресной воды. Как следствие соленая вода закипает позднее пресной. В соленой воде присутствуют ионы Na+ и Cl-, которые занимают определенную область между молекулами воды.
В соленой воде молекулы воды присоединяются к ионам соли – данные процесс имеет название «гидратация». Связь между молекулами воды значительно слабее связи, образовавшейся в процессе гидратации.
На закипание воды с растворенной солью потребуется больше энергии, в качестве которой в данном случае выступает температура.
По мере увеличения температуры молекулы в соленой воде начинаются двигаться быстрее, но при этом их становится меньше, ввиду чего они сталкиваются реже. В результате образуется меньше пара, давление которого ниже, нежели у пара пресной воды.
Для того чтобы в соленой воде давление стало выше атмосферного и начался процесс кипения, необходима более высокая температура. При добавлении 60 граммов соли в воду объемом 1 литр температура кипения увеличится на 10 С.
[w[wpmfc_short code=»Block3"]r>
Почему температура жидкости при кипении не изменяется
Тепловая энергия, которую получает жидкость во время кипения, тратится на образование пара во всем объеме жидкости. Поэтому во время кипения температура жидкости не изменяется.
Разберем подробнее, что происходит, когда мы сообщаем тепловую энергию какой-либо жидкости.
Получаемая от источника тепловая энергия передается молекулам жидкости. Скорость движения молекул увеличивается, а значит, растет их кинетическая энергия. Чем выше температура, тем быстрее будут двигаться молекулы.
Находясь в жидкости, каждая молекула притягиваются к соседним молекулам. То есть, молекулы удерживаются в жидкости силами притяжения соседних молекул. Если есть взаимодействие молекул – их взаимное притяжение, значит, есть потенциальная энергия такого взаимодействия.
По мере нагревания, энергия движения некоторых молекул увеличится настолько, что они преодолеют притяжение соседних молекул и, покинут жидкость. Чем выше температура, тем большее число молекул сможет покинуть жидкость.
Мы помним, что при испарении жидкость покидают молекулы, находящиеся только на ее поверхности. А во время кипения энергию, достаточную для того, чтобы вылететь из жидкости, получают не только молекулы на поверхности, но и молекулы, находящиеся внутри жидкости.
Примечания:
- Наблюдая за кипящей жидкостью, можно заметить, что пар образуется внутри жидкости во всем ее объеме. Пузырьки пара буду образовываться даже у дна. Они будут подниматься к поверхности, при этом расширяясь. Внутри пузырьков находятся молекулы, энергия которых достаточна для того, чтобы покинуть жидкость.
- Вместо слов «Внутри жидкости», физики говорят — «Во всем объеме жидкости».
Температура кипения воды в вакууме при различном давлении
| Давление (P) — кПа | Температура (t) — °С |
| 10 | 45.82 |
| 20 | 60.07 |
| 30 | 69.11 |
| 40 | 75.88 |
| 50 | 81.34 |
| 60 | 85.95 |
| 70 | 89.96 |
| 80 | 93.51 |
Температура
| Высота, км | Температура | |
| К | oC | |
| 288,15 | 15,00 | |
| 0,050 | 287,82 | 14,67 |
| 0,1 | 287,50 | 14,35 |
| 0,2 | 286,85 | 13,70 |
| 0,3 | 286,20 | 13,05 |
| 0,5 | 284,90 | 11,75 |
| 1 | 281,65 | 8,50 |
| 2 | 275,15 | 2,00 |
| 3 | 268,66 | -4,49 |
| 5 | 255,68 | -17,47 |
| 8 | 236,22 | -36,93 |
| 10 | 223,25 | -49,90 |
| 12 | 216,65 | -56,50 |
| 15 | 216,65 | -56,50 |
| 20 | 216,65 | -56,50 |
| 30 | 226,51 | -46,64 |
| 50 | 270,65 | -2,50 |
| 100 | 196,60 | -76,55 |
| 120 | 337,42 | 61,27 |
В зависимости от вертикального распределения температуры атмосферу делят на пять слоев: тропосферу (высота нижней и верхней границы тропосферы от 0 до 11-16 км), стратосферу (от 11-16 до 50-55 км), мезосферу (от 50-55 до 80 км), термосферу (от 80 до 600-800 км) и экзосферу (выше 600-800 км). Температура воздуха от поверхности Земли, где она принимается равной 15 °С, до верхней границы тропосферы понижается в среднем на 6 «С на 1 км подъема. В нижней части стратосферы (до высоты 20 км) температура атмосферы остается приблизительно постоянной, а затем повышается в среднем на 1-2 °С на 1 км подъема и на верхней границе ( примерно 50 км) становится равной -2,5 °С. В мезосфере температура с высотой понижается, и у верхней границы мезосферы (примерно 80 км) температура атмосферы достигает -75 °С. По мере дальнейшего увеличения высоты вновь происходит повышение температуры. Это же характерно и для термосферы, где температура, возрастая с увеличением высоты, достигает очень больших значений (свыше 1000 °С). В малоизученной области атмосферы — экзосфере — температура с увеличением высоты возрастает предположительно до 2000 °С.
Как известно, зависимость температуры кипения воды от давления характеризируется уравнением Клаузиуса-Клапейрона – P2/P1 = EXP(qμв/R(1/T1-1/T2)), а зависимость давления от высоты барометричкеской формулой – P=PoEXP(-μгgh/RT).
Сопоставляя, два уравнения получаем формулу зависимости температуры кипения воды от высоты – Th=ToTг qμв/qμвTг+ μгghTo, где
- To — температура кипения воды при нормальных условиях;
- Tг – Температура воздуха;
- q = 2300000 Дж/кг – удельная теплота испарения воды;
- μв= 0,018 кг/моль – молярная масса воды;
- μг= 0,029 кг/моль – молярная масса воздуха;
- g — ускорение свободного падения;
- h — высота.
Температура кипения воды в вакууме
Известно, что при нормальном атмосферном давлении вода закивает при температуре 100 градусах C. Нормальное атмосферное давление составляет 101,325 кПа.
При снижении окружающего давления вода закипает и испаряется быстрее. Вакуум – свободное от вещества пространство. Технический вакуум – среда, содержащая газ под давлением, которое значительно ниже атмосферного.
В вакууме остаточное давление составляет примерно 4 кПа. При таком показателе давления точкой кипения воды будет 300 С. Чем выше давление в вакууме, тем больше величина температуры кипения воды.
Как кипит H2O в таких условиях?
В любом сосуде, заполненном водой, всегда присутствуют частички воздуха. Они остаются на микроскопических трещинах, имеющихся на стенках емкости. По мере нагрева пузырьки увеличиваются, и становятся видимыми невооруженным взглядом, особенно на стенках сосуда и его дне. По сути, это капли насыщенного пара, растворенные в воде.
На определенном этапе пузырьки под действием силы Архимеда начинают выталкиваться наружу. Вода бурлит, но еще не кипит. Это связано с тем, что нагрев происходит неравномерно.
Когда температура на дне сосуда уже достигла 100 °C, а на поверхности воды ещё нет, сила поверхностного натяжения и атмосферное давление препятствуют выходу частиц за пределы емкости. Они возвращаются назад, теряя температуру.
Когда степень нагрева поверхностного и придонного слоя выравнивается, вещество закипает. В вакууме частицам легче покинуть объем сосуда. Этому препятствует только поверхностное натяжение, поэтому кипение начинается при более низкой температуре.
Температура кипения воды в чайнике
Кипяток – вода, доведенная до температуры кипения. Как правило, для получения кипятка используются чайники. Остывшая вода, прежде доведенная до кипения, называется кипяченой.
В процессе кипения воды обильно выделяется пар. Процесс парообразования сопровождается выделением из состава жидкости свободных молекул кислорода. Чистая пресная вода закипает в чайнике при температуре 100 градусов С.
В кипятке погибает большинство болезнетворных бактерий за счет длительного воздействия высокой температуры на воду. При кипении из солей, содержащихся в жесткой воде, образуется осадок, который известен нам как накипь.
Обычно кипяченую воду применяют для заваривания кофе и чая, а также для дезинфекции овощей и фруктов и т.д.
Хороший способ поправить свое здоровье — это пить минеральную воду. Узнайте больше про щелочные минеральные воды Украины названия которых наиболее известны, насколько они полезны, сколько стоят? Это интересно!
Какие сейчас цены на насосы для повышения давления воды, и как определить, стоит ли он своих денег? Об этом можно прочитать здесь, сделайте правильный выбор!
Кстати, а вы знаете, какой состав у морской воды? Об этом можно прочитать в статье: https://pro8odu.ru/vidy-vody/seawater/pochemu-nelzya-pit-morskuyu-vodu.html, это очень интересно!
Температура кипения и как ее найти на графике
Чтобы жидкость закипела, ее нужно нагреть до температуры кипения.
На рисунке 5 представлен температурный график нагревания воды. Температуру кипения можно определить по горизонтальной линии, обозначающую процесс кипения. Нужно продолжить эту линию пунктиром по направлению к вертикальной оси температур. Точка, в которой пунктир упрется в ось и будет температурой кипения жидкости.
Рис. 5. Если на графике температуры найти горизонтальную линию кипения, а потом провести пунктир к оси температуры, мы найдем температуру кипения
Температура кипения – это температура, при которой пар образуется во всем объеме жидкости. Такая температура у каждой жидкости своя, ее можно найти в справочнике физики.
Температуры кипения некоторых веществ
Сравним для наглядности значения температуры кипения некоторых веществ.
Нам известно, что температура кипения питьевой воды равна 100 градусам на шкале Цельсия.
При комнатной температуре некоторые вещества пребывают в газообразном состоянии, но при более низких температурах они превращаются в жидкости. Например, кислород превращается в кипящую жидкость при минус 183 градусах Цельсия.
В противоположность этому, вещества, которые мы привыкли видеть твердыми при комнатной температуре, в кипящую жидкость превратятся при более высоких температурах. К примеру, медь станет кипящей жидкостью при 2567 град. Цельсия, а железо – при 2500 град. Цельсия
На рисунке 6 представлен список некоторых веществ и указана температура, при которой эти вещества кипят.
Рис. 6. Таблица — температура кипения некоторых веществ
Расширенный список жидкостей и их температуру кипения можно найти в справочнике физики.
Температура кипения воды в горах
Как уже упоминалось выше, величина температуры кипения воды напрямую зависит от внешнего давления. Чем ниже будет атмосферное давление, тем меньше станет показатель температуры кипения.
Известно, что атмосферное давление значительно падает над уровнем моря. Поэтому в горах давление будет намного ниже, чем на уровне моря.
Любой альпинист знает, что в горах сложно заварить чай, поскольку вода недостаточно нагревается. Также в горах требуется больше времени, чтобы сварить пищу.
Поэтому была составлена специальная таблица, отражающая температуру закипания воды в зависимости от высоты.
Другие причины
Прогоревшая прокладка блока цилиндров также может стать причиной закипания тосола. В этом случае также нарушается герметичность системы охлаждения. Уровень антифриза будет резко снижаться. Прокладку потребуется заменить, иначе температура кипения тосола будет снижена из-за недостаточного давления в системе.
Также причиной неисправности может стать насос для воды другого производителя, загрязненность радиатора или плохая циркуляция воздуха. Чтобы была нормальная обдувка, вентилятор на водяном насосе должен иметь особый кожух. Иначе горячий воздух будет дуть на него, нагреваясь в подкапотном пространстве.
Лопасти насоса неподходящей модели могут иметь значительно меньшие размеры, чем это требуется. Это приведет к снижению давления в системе.
Температуры кипения воды на разных высотах
| Высота над уровнем моря (метры) | Температура закипания воды (0С) |
| 0 | 100.0 |
| 500 | 98.3 |
| 1000 | 96.7 |
| 1500 | 95.0 |
| 2000 | 93.3 |
| 2500 | 91.7 |
| 3000 | 90.0 |
| 3500 | 88.3 |
| 4000 | 86.7 |
| 4500 | 85.0 |
| 5000 | 83.8 |
| 6000 | 80 |
Данные показатели могут меняться, если в состав воды входят примеси. При наличии нелетучих примесей температура кипения воды будет увеличиваться.
Зависимость температуры кипения жидкости от давления
Из приведенныхрассуждений ясно, что температуракипения жидкости должна зависеть отвнешнего давления. Наблюдения подтверждаютэто.
Чембольше внешнее давление, тем вышетемпература кипения. Так, в паровомкотле при давлении, достигающем 1,6 · 106Па, вода не кипит и при температуре 200°С.
В медицинских учреждениях кипениеводы в герметически закрытых сосудах— автоклавах (рис. 6.11) также происходитпри повышенном давлении. Поэтомутемпература кипения значительно выше100 °С.
Автоклавы применяют для стерилизациихирургических инструментов, перевязочногоматериала и т. д.
Рис. 6.11
Инаоборот, уменьшая внешнее давление,мы тем самым понижаем температурукипения. Под колоколом воздушного насосаможно заставить воду кипеть при комнатнойтемпературе (рис. 6.12).
При подъеме в горыатмосферное давление уменьшается,поэтому уменьшается температура кипения.На высоте 7134 м (пик Ленина на Памире)давление приближенно равно 4 · 104Па (300 мм рт. ст.). Вода кипит там примернопри 70 °С.
Сварить, например, мясо в этихусловиях невозможно.
Рис. 6.12
На рисунке 6.13изображена кривая зависимости температурыкипения воды от внешнего давления. Легкосообразить, что эта кривая являетсяодновременно и кривой, выражающейзависимость давления насыщенноговодяного пара от температуры.
Рис. 6.13
Различие температур кипения жидкостей
У каждой жидкостисвоя температура кипения. Различиетемператур кипения жидкостей определяетсяразличием в давлении их насыщенныхпаров при одной и той же температуре.Например, пары эфира уже при комнатнойтемпературе имеют давление, большееполовины атмосферного.
Поэтому, чтобыдавление паров эфира стало равныматмосферному, нужно небольшое повышениетемпературы (до 35 °С). У ртути же насыщенныепары имеют при комнатной температуресовсем ничтожное давление. Давлениепаров ртути делается равным атмосферномутолько при значительном повышениитемпературы (до 357 °С).
Именно при этойтемпературе, если внешнее давлениеравно 105 Па, и кипит ртуть.
Различие температуркипения веществ находит большоеприменение в технике, например приразделении нефтепродуктов. При нагреваниинефти раньше всего испаряются наиболееценные, летучие ее части (бензин), которыеможно таким образом отделить от «тяжелых»остатков (масел, мазута).
Жидкость закипает,когда давление ее насыщенного парасравнивается с давлением внутри жидкости.
§ 6.6. Теплота парообразования
Требуется лиэнергия для превращения жидкости в пар?Скорее всего да! Не так ли?
Мы отмечали (см. §6.1), что испарение жидкости сопровождаетсяее охлаждением. Для поддержаниятемпературы испаряющейся жидкостинеизменной к ней необходимо подводитьизвне теплоту.
Конечно, теплота и самаможет передаваться жидкости от окружающихтел. Так, вода в стакане испаряется, нотемпература воды, несколько болеенизкая, чем температура окружающеговоздуха, остается неизменной.
Теплотапередается от воздуха к воде до тех пор,пока вся вода не испарится.
Чтобы поддерживатькипение воды (или иной жидкости), к нейтоже нужно непрерывно подводить теплоту,например подогревать ее горелкой. Приэтом температура воды и сосуда неповышается, но каждую секунду образуетсяопределенное количество пара.
На что расходуетсяподводимая к телу энергия? Прежде всегона увеличение его внутренней энергиипри переходе из жидкого состояния вгазообразное: ведь при этом увеличиваетсяобъем вещества от объема жидкости дообъема насыщенного пара. Следовательно,увеличивается среднее расстояние междумолекулами, а значит, и их потенциальнаяэнергия.
Кроме того, приувеличении объема вещества совершаетсяработа против сил внешнего давления.Эта часть теплоты парообразования прикомнатной температуре составляет обычнонесколько процентов всей теплотыпарообразования.
Теплотапарообразования зависит от рода жидкости,ее массы и температуры. Зависимостьтеплоты парообразования от рода жидкостихарактеризуется величиной, называемойудельнойтеплотой парообразования.
Удельной теплотойпарообразования данной жидкостиназывается отношение теплотыпарообразования жидкости к ее массе:
(6.6.1)
гдеr
— удельная теплота парообразованияжидкости;
т
—масса жидкости;
Qn
— ее теплота парообразования. Единицейудельной теплоты парообразования в СИявляется джоульна килограмм (Дж/кг).
Удельнаятеплота парообразования воды оченьвелика: 2,256·106Дж/кг при температуре 100 °С. У другихжидкостей (спирт, эфир, ртуть, керосини др.) удельная теплота парообразованияменьше в 3—10 раз.
Температура кипения дистиллированной воды
Дистиллированная вода – это очищенная вода H2O, в которой практически не содержится каких-либо примесей. Обычно ее используют в медицинских, технических или исследовательских целях.
Дистиллированная вода не предназначена для питья или приготовления пищи. Такую воду производят в специальном оборудовании – дистилляторах, где происходит выпаривание пресной воды и последующая конденсация пара.
Данный процесс называется «дистилляция». После дистилляции все присутствовавшие в воде примеси остаются в выпаренном остатке.
Температура кипения дистиллированной воды будет такой же, как и у обычной водопроводной воды — 100 градусов Цельсия. Разница же заключается в том, что дистиллированная вода будет закипать быстрее по времени, нежели пресная.
Однако этот показатель практически не отличается от времени закипания обычной воды: разница состоит в считанных долях секунды.
Использование кипячения как метода очистки
Кипячение является популярным методом очистки воды. Однако нужно понимать, что далеко не все бактерии и примеси уничтожаются при обычных ста градусах. Поэтому в очистке воды не стоит полагаться на одно только кипячение.
Кроме того, кипячение длительное время являлось основным методом стерилизации медицинских инструментов. И для этой цели кипячение при нормальных условиях не является эффективным.
Кипячение можно использовать для очистки предметов (в том числе посуды, кухонных поверхностей) от загрязнений. Кипяток хорошо расплавляет многие вещества. Какие же вещества можно расплавить в кипящей воде? Все вещества, имеющие температуру плавления ниже 100 градусов Цельсия. А это, в частности, многие жиры.
Удельная теплота кипения воды
Удельная теплота кипения воды или парообразования – это физическая величина, отражающая количество теплоты, необходимое для превращения 1 л кипящей воды в пар.
Процесс кипения воды, как и любого другого вещества, происходит с поглощением теплоты. Значительная часть проводимой теплоты необходима для разрыва связей между молекулами воды.
Другая часть теплоты расходуется на процессы, происходящие при расширении пара. В результате поглощения теплоты увеличивается энергия взаимодействия между частицами пара.
Эта энергия становится больше энергии взаимодействия молекул воды. Таким образом, при одинаковой температуре внутренняя энергия пара становится выше внутренней энергии жидкости.
Единица удельной теплоты парообразования в системе СИ: [ L][ L] Дж/кг.
Удельная теплота испарения воды равна 2260 кДж/кг.
Небольшое видео — измерение температуры кипения воды:
Причины кипения
Существует ряд причин, из-за которых антифриз может закипеть.
Частыми являются неисправность термостата, помпы, вентилятора или радиатора. Также недостаточный уровень хладагента или воздушная пробка приводят к сбоям в работе.
Механические поломки систем вентилятора или термостата позволяют быстро определить и устранить закипание жидкости. Аварийное повышение температуры тосола будет длиться в этом случае всего около 10 минут, не нанеся большого вреда системам автомобиля.
Если было произведено некачественное техобслуживание, водитель может не определить аварийную ситуацию на протяжении 20 минут. Кипящая жидкость в этом случае сможет нанести существенный ущерб системам двигателя.
Перегрев, длящийся более 30 минут, способен разрушить двигатель и близкие к нему системы. Взрыв двигателя возможен, но маловероятен.
От чего зависит?
Это параметр зависим от следующих факторов:
Нагрев. Он заставляет молекулы воды двигаться быстрее, постепенно уравнивая давление ее насыщенного пара с атмосферным.
При достаточном нагревании их значения выравниваются. В этот момент вода начинает кипеть.- Давление окружающей среды – второй по значимости фактор после нагрева. Его сокращение снижает порог закипания.
- Чистота воды незначительно, но влияет на ее закипание. Частицы посторонних включений тяжелее водяных, и для их разгона нужно больший разогрев. Поэтому чем сильнее загрязнение воды, тем выше граница ее закипания.
Зависимость температуры кипения жидкости от давления
Из приведенныхрассуждений ясно, что температуракипения жидкости должна зависеть отвнешнего давления. Наблюдения подтверждаютэто.
Чембольше внешнее давление, тем вышетемпература кипения. Так, в паровомкотле при давлении, достигающем 1,6 · 106Па, вода не кипит и при температуре 200°С.
В медицинских учреждениях кипениеводы в герметически закрытых сосудах— автоклавах (рис. 6.11) также происходитпри повышенном давлении. Поэтомутемпература кипения значительно выше100 °С.
Автоклавы применяют для стерилизациихирургических инструментов, перевязочногоматериала и т. д.
Рис. 6.11
Инаоборот, уменьшая внешнее давление,мы тем самым понижаем температурукипения. Под колоколом воздушного насосаможно заставить воду кипеть при комнатнойтемпературе (рис. 6.12).
При подъеме в горыатмосферное давление уменьшается,поэтому уменьшается температура кипения.На высоте 7134 м (пик Ленина на Памире)давление приближенно равно 4 · 104Па (300 мм рт. ст.). Вода кипит там примернопри 70 °С.
Сварить, например, мясо в этихусловиях невозможно.
Рис. 6.12
На рисунке 6.13изображена кривая зависимости температурыкипения воды от внешнего давления. Легкосообразить, что эта кривая являетсяодновременно и кривой, выражающейзависимость давления насыщенноговодяного пара от температуры.
Рис. 6.13
Различие температур кипения жидкостей
У каждой жидкостисвоя температура кипения. Различиетемператур кипения жидкостей определяетсяразличием в давлении их насыщенныхпаров при одной и той же температуре.Например, пары эфира уже при комнатнойтемпературе имеют давление, большееполовины атмосферного.
Поэтому, чтобыдавление паров эфира стало равныматмосферному, нужно небольшое повышениетемпературы (до 35 °С). У ртути же насыщенныепары имеют при комнатной температуресовсем ничтожное давление. Давлениепаров ртути делается равным атмосферномутолько при значительном повышениитемпературы (до 357 °С).
Именно при этойтемпературе, если внешнее давлениеравно 105 Па, и кипит ртуть.
Различие температуркипения веществ находит большоеприменение в технике, например приразделении нефтепродуктов. При нагреваниинефти раньше всего испаряются наиболееценные, летучие ее части (бензин), которыеможно таким образом отделить от «тяжелых»остатков (масел, мазута).
Жидкость закипает,когда давление ее насыщенного парасравнивается с давлением внутри жидкости.
§ 6.6. Теплота парообразования
Требуется лиэнергия для превращения жидкости в пар?Скорее всего да! Не так ли?
Мы отмечали (см. §6.1), что испарение жидкости сопровождаетсяее охлаждением. Для поддержаниятемпературы испаряющейся жидкостинеизменной к ней необходимо подводитьизвне теплоту.
Конечно, теплота и самаможет передаваться жидкости от окружающихтел. Так, вода в стакане испаряется, нотемпература воды, несколько болеенизкая, чем температура окружающеговоздуха, остается неизменной.
Теплотапередается от воздуха к воде до тех пор,пока вся вода не испарится.
Чтобы поддерживатькипение воды (или иной жидкости), к нейтоже нужно непрерывно подводить теплоту,например подогревать ее горелкой. Приэтом температура воды и сосуда неповышается, но каждую секунду образуетсяопределенное количество пара.
На что расходуетсяподводимая к телу энергия? Прежде всегона увеличение его внутренней энергиипри переходе из жидкого состояния вгазообразное: ведь при этом увеличиваетсяобъем вещества от объема жидкости дообъема насыщенного пара. Следовательно,увеличивается среднее расстояние междумолекулами, а значит, и их потенциальнаяэнергия.
Кроме того, приувеличении объема вещества совершаетсяработа против сил внешнего давления.Эта часть теплоты парообразования прикомнатной температуре составляет обычнонесколько процентов всей теплотыпарообразования.
Теплотапарообразования зависит от рода жидкости,ее массы и температуры. Зависимостьтеплоты парообразования от рода жидкостихарактеризуется величиной, называемойудельнойтеплотой парообразования.
Удельной теплотойпарообразования данной жидкостиназывается отношение теплотыпарообразования жидкости к ее массе:
(6.6.1)
гдеr
— удельная теплота парообразованияжидкости;
т
—масса жидкости;
Qn
— ее теплота парообразования. Единицейудельной теплоты парообразования в СИявляется джоульна килограмм (Дж/кг).
Удельнаятеплота парообразования воды оченьвелика: 2,256·106Дж/кг при температуре 100 °С. У другихжидкостей (спирт, эфир, ртуть, керосини др.) удельная теплота парообразованияменьше в 3—10 раз.
Таблица 3.3.10
Температуры кипения или возгонки (°С) органических веществ при давлении пара выше 101,3 кПа
| Формула | Название | Температура кипения или возгонки при давлении насыщенного пара | Критическая температура, °С | Критическое давление, МПа | |||||
| 0,101 МПа | 0,203 МПа | 0,507 МПа | 1,013 МПа | 2,027 МПа | 5,066 МПа | ||||
| С1 | |||||||||
| CClF3 | Трифторхлорметан (фреон-13) | –81,2 | –66,7 | –42,7 | –18,5 | 12,0 | 28,8 | 3,95 | |
| CCl2F2 | Дифтордихлорэтан (фреон-12) | –29,8 | –12,2 | 16,1 | 42,4 | 74,0 | 111,5 | 4,01 | |
| CCl2O | Фосген | 7,9 | 27,3 | 57,2 | 84,6 | 119,0 | 174,0 | 182 | 5,67 |
| CCl3F | Фтортрихлорметан (фреон-11) | 23,7 | 44,1 | 77,3 | 108,2 | 146,7 | 198,0 | 4,38 | |
| CCl4 | Тетрахлорметан | 76,5 | 102,0 | 141,7 | 178,0 | 222,0 | 283,2 | 4,56 | |
| CHClF2 | Дифторхлорметан (фреон-22) | –40,8 | –24,7 | 0,4 | 24,0 | 52,0 | 96,4 | 4,91 | |
| CHCl2F | Фтордихлорметан (фреон-21) | 8,9 | 29,4 | 59,0 | 87,0 | 121,2 | 177,5 | 178,5 | 5,17 |
| CHCl3 | Хлороформ | 61,7 | 120,0 | 152,3 | 191,8 | ||||
| CH3Br | Бромметан | 3,6 | 23,3 | 54,8 | 84,0 | 121,7 | 190,0 | 191 | |
| CH3Cl | Хлорметан | –24,2 | –6,4 | 22,0 | 47,3 | 77,3 | 126,0 | 143,1 | 6,68 |
| CH3F | Фторметан | –7,3 | –64,5 | –42,0 | –21,0 | 2,6 | 36,0 | 44,6 | 5,88 |
| CH3I | Иодметан | 42,4 | 65,5 | 101,8 | 138,0 | 176,5 | 248,1 | 255 | |
| CH4 | Метан | –161,6 | –153,0 | –137,5 | –123,6 | –107,0 | –82,1 | 4,64 | |
| CH4O | Метанол | 64,7 | 83,7 | 111,7 | 137,3 | 166,5 | 212 | 240 | 7,95 |
| CH4S | Метантиол | 6,8 | 26,1 | 55,9 | 83,4 | 117,5 | 172,0 | 196,8 | 71,4 |
| CH5N | Метанамин | –6,3 | 10,1 | 36,0 | 59,5 | 87,8 | 133,7 | 156,9 | 7,23 |
| C2 | |||||||||
| C2ClF3 | Трифторхлорэтилен | –27,9 | –11,1 | 15,5 | 40,0 | 71,1 | 106 | 4,05 | |
| C2Cl2F4 | 1,1,1,2-Тетрафтор-2,2-дихлорэтан | 3,0 | 54,5 | 83,1 | 117,2 | ||||
| C2Cl2F4 | 1,1,2,2-Тетрафтор-1,2-дихлорэтан | 3,5 | 22,8 | 54,0 | 82,3 | 117,5 | 145,7 | 3,27 | |
| C2Cl3F3 | 1,1,2-Трифтор-1,2,2-трихлорэтан (фреон-113) | 47,5 | 70,0 | 105,5 | 138,0 | 177,7 | 214,1 | 3,41 | |
| C2F4 | Тетрафторэтилен | –76,5 | –39,6 | –19,2 | 4,9 | ||||
| C2N2 | Оксалонитрил(дициан) | –21,2 | –4,4 | 21,4 | 44,6 | 72,6 | 118,2 | 127 | 5,98 |
| C2HClF2 | 1,1-Дифтор-2-хлорэтилен | –58,6 | –15,7 | 9,4 | 39,9 | 104,5 | |||
| C2H2 | Ацетилен | –83,6 (тв.) | –72,2 | –51,2 | –32,3 | –10,0 | 26,3 | 36 | 6,24 |
| C2H2Cl2 | (E)-1,2-Дихлорэтилен | 47,9 | 69,8 | 104,0 | 135,7 | 173,7 | 236,5 | 243,3 | 5,52 |
| C2H2Cl2 | (Z)-1,2-Дихлорэтилен | 60,8 | 83 | 119,5 | 152,5 | 193,4 | 260,5 | 271,0 | 5,87 |
| C2H2F2 | 1,1-Дифторэтилен | –85,7 | –49,4 | –28,9 | –4,4 | ||||
| C2H3ClF2 | 1,1-Дифтор-1-хлорэтан | 38,7 | 65,5 | 97,4 | |||||
| C2H3F3 | 1,1,1-Трифторэтан | –47,5 | –6,2 | 17,8 | 44,1 | ||||
| C2H4 | Этилен | –103,7 | –91,0 | –70,5 | –51,4 | –28,4 | 8,9 | 9,9 | 5,12 |
| C2H4Br2 | 1,2-Дибромэтан | 131,4 | 157,7 | 200,0 | 237,0 | 269,0 | 300,0 | 309,8 | 7,15 |
| C2H4Cl2 | 1,1-Дихлорэтан | 57,4 | 80,2 | 117,3 | 150,3 | 192,7 | 250 | 250 | 5,07 |
| C2H4Cl2 | 1,2-Дихлорэтан | 83,5 | 108,1 | 147,8 | 183,5 | 226,5 | 285,0 | 288 | 5,37 |
| C2H4F2 | 1,1-Дифторэтан | –26,5 | 19,5 | 44,0 | 72,9 | ||||
| C2H4O | Оксиран (окись этилена) | 10,4 | 57,7 | 83,6 | 114,0 | ||||
| C2H4O2 | Метилформиат | 32,0 | 51,9 | 83,5 | 112,0 | 147,2 | 213,0 | 214,0 | 6,00 |
| C2H4O2 | Уксусная кислота | 117,9 | 143,5 | 180,3 | 214,0 | 252,0 | 312,5 | 321,6 | 5,79 |
| C2H5Br | Бромэтан | 38,4 | 60,2 | 95,0 | 126,8 | 164,3 | 220,0 | 230,7 | 6,23 |
| C2H5Cl | Хлорэтан | 12,3 | 32,5 | 64,0 | 92,6 | 127,3 | 180,5 | 187,2 | 5,27 |
| C2H5F | Фторэтан | –32,0 | –16,7 | 7,7 | 30,2 | 57,5 | 102,2 | 4,66 | |
| C2H6 | Этан | –88,6 | –75,5 | –52,1 | –31,0 | –6,6 | 32,3 | 4,88 | |
| C2H6Hg | Диметилртуть | 21,9 | 88,9 | 128,1 | |||||
| C2H6O | Диметиловый эфир | –23,7 | –6,4 | 20,8 | 45,5 | 75,7 | 125,2 | 126,9 | 5,37 |
| C2H6O | Этанол | 78,4 | 97,5 | 126,0 | 151,8 | 183,0 | 230,0 | 243 | 6,38 |
| C2H6S | Диметилсульфид | 36,0 | 57,8 | 92,3 | 124,5 | 163,8 | 224,5 | 229,9 | 5,53 |
| C2H6S | Этантиол | 35,0 | 56,6 | 90,7 | 121,9 | 159,5 | 220,0 | 226 | 5,49 |
| C2H7N | N-Метилметанамин | 7,4 | 25,0 | 53,9 | 80,8 | 111,7 | 162,6 | 164,5 | 5,31 |
| C2H7N | Этанамин | 16,6 | 35,7 | 65,3 | 91,8 | 124,0 | 176,0 | 183 | 5,62 |
| C3 | |||||||||
| C3H4 | Аллен | –34,3 | –18,4 | 8,0 | 33,2 | 64,5 | 118,0 | 120,7 | 5,25 |
| C3H4 | Пропин | –23,0 | –7,1 | 19,5 | 43,8 | 74,0 | 125,0 | 128 | 5,35 |
| C3H6 | Пропен | –47,7 | –31,3 | –4,7 | 20,1 | 49,4 | 91,8 | 4,62 | |
| C3H6O | Ацетон | 56,5 | 89,6 | 113,0 | 144,5 | 181,0 | 235,5 | 4,72 | |
| C3H6O2 | Метилацетат | 57,8 | 97,5 | 113,1 | 144,2 | 181,0 | 233,7 | 4,69 | |
| C3H6O2 | Пропионовая кислота | 141,1 | 186,0 | 203,5 | 220,0 | ||||
| C3H6O2 | Этилформиат | 54,3 | 76,0 | 110,5 | 142,2 | 180,0 | 235,3 | 4,74 | |
| C3H8 | Пропан | –42,1 | –26,1 | 2,5 | 28,0 | 57,9 | 96,8 | 4,26 | |
| C3H8O | Метоксиэтан | 7,5 | 26,5 | 56,4 | 84,0 | 108,0 | 164,7 | 4,4 | |
| C3H8O | Пропан-1-ол | 97,8 | 117,0 | 149,0 | 177,0 | 210,8 | 264 | 5,09 | |
| C3H8O | Пропан-2-ол | 82,5 | 101,3 | 130,2 | 155,7 | 186,0 | 232,0 | 235,6 | 5,37 |
| C3H9N | N,N-Диметилметанамин | 2,9 | 54,2 | 83,5 | 118,4 | ||||
| C3H9N | Пропан-1-амин | 48,5 | 70 | 103 | 134 | 170 | 223,8 | 4,74 | |
| C4 | |||||||||
| C4H5N | Пиррол | 130 | 156 | 195 | 232 | 275 | 342 | 352 | 5,67 |
| C4H6 | Бута-1,3-диен(дивинил) | –4,4 | 14,5 | 44,7 | 73,0 | 114,0 | 152 | 4,33 | |
| C4H6O3 | Уксусный ангидрид | 138,6 | 162,0 | 194,0 | 221,5 | 253,0 | 296 | 4,68 | |
| C4H6O4 | Диметилоксалат | 163,3 | 189,6 | 228,7 | 260 | 0,96 | |||
| C4H8 | Бут-1-ен | –6,3 | 43,5 | 71,8 | 105,5 | ||||
| C4H8 | (Z)-Бут-2-ен | 3,7 | 23,4 | 54,9 | 84,3 | 146 | 4,05 | ||
| C4H8 | (E)-Бут-2-ен | 0,9 | 52,0 | 80,5 | 114,5 | ||||
| C4H8 | 2-Метилпропен | –7,0 | 12,5 | 43,2 | 71,4 | 105,2 | 144,7 | 4,00 | |
| C4H8O | Бутан-2-он | 79,6 | 139,5 | 173,3 | 213,0 | ||||
| C4H8O2 | 1,4-Диоксан | 101,1 | 125 | 164 | 200 | 242 | 308 | 312 | 5,14 |
| C4H8O2 | Изомасляная кислота | 154,5 | 179,8 | 217,0 | 250,0 | 289,0 | 336 | 4,05 | |
| C4H8O2 | Масляная кислота | 163,5 | 188,3 | 225,0 | 257,0 | 295,0 | 352,0 | 355 | 5,27 |
| C4H8O2 | Пропилформиат | 81,3 | 104,3 | 142,0 | 176,4 | 217,5 | 264,9 | 4,06 | |
| C4H8O2 | Этилацетат | 77,1 | 100,6 | 136,6 | 169,7 | 209,5 | 250,1 | 3,83 | |
| C4H8O2 | Метилпропионат | 79,8 | 103,0 | 139,8 | 172,6 | 212,5 | 257,4 | 3,98 | |
| C4H10 | Бутан | –0,5 | 18,1 | 51,2 | 80,7 | 115,3 | 152,0 | 3,8 | |
| C4H10 | Изобутан | –11,7 | 7,5 | 39,0 | 69,3 | 108,7 | 134,9 | 3,65 | |
| C4H10O | Бутан-1-ол | 117,5 | 139,8 | 172,5 | 203,0 | 237,0 | 287,0 | 4,92 | |
| C4H10O | Бутан-2-ол | 99,5 | 118,2 | 147,5 | 172,0 | 204,0 | 265 | ||
| C4H10O | 2-Метилпропан-1-ол | 108,0 | 127,3 | 156,2 | 182,0 | 212,5 | 265 | ||
| C4H10O | 2-Метилпропан-2-ол | 82,9 | 102,0 | 130,0 | 154,2 | 184,5 | 235 | 4,86 | |
| C4H10O | Диэтиловый эфир | 34,6 | 55,5 | 89,0 | 119,8 | 156,4 | 194 | 3,61 | |
| C4H10S | Диэтилсульфид | 88,0 | 11,0 | 153,8 | 190,2 | 234,0 | 284 | 3,96 | |
| C4H11N | Бутан-1-амин | 70 | 100 | 136 | 167,5 | 205,5 | 251 | 4,15 | |
| C4H11N | N-Этилэтанамин | 55,5 | 77,8 | 113,0 | 145,3 | 184,5 | 223 | 3,71 | |
| C4H12Si | Тетраметилсилан | 27,0 | 48,0 | 82,0 | 113,0 | 152,0 | 185 | 3,34 | |
| C5 | |||||||||
| C5H10 | 2-Метилбут-1-ен | 31,2 | 88,1 | 119,9 | 157,8 | ||||
| C5H10 | Пент-1-ен | 30,0 | 86,0 | 118,0 | 156,1 | ||||
| C5H10 | Циклопентан | 49,3 | 72,1 | 109,3 | 142,6 | 182,2 | 238,6 | 4,52 | |
| C5H10O | 3-Метилбутан-2-он | 88,9 | 153,4 | 189,6 | 232,7 | ||||
| C5H10O | Пентан-2-он | 103,3 | 165,0 | 200,9 | 243,3 | ||||
| C5H10O | Пентан-3-он | 102,7 | 164,7 | 200,8 | 243,4 | ||||
| C5H10O2 | Изобутилформиат | 98,2 | 121,8 | 157,8 | 192,4 | 234,0 | 278,2 | 3,88 | |
| C5H10O2 | Пропилацетат | 101,8 | 126,8 | 165,7 | 200,5 | 242,8 | 276,2 | 3,33 | |
| C5H10O2 | Этилпропионат | 99,1 | 123,8 | 162,7 | 197,8 | 240,0 | 272,9 | 3,34 | |
| C5H10O2 | Метилбутират | 102,3 | 127,5 | 166,7 | 203,0 | 244,5 | 281,3 | 3,48 | |
| C5H10O2 | Метилизобутират | 92,6 | 116,7 | 155,2 | 190,2 | 232,0 | 267,6 | 3,43 | |
| C5H12 | Изопентан | 27,8 | 49,8 | 84,7 | 114,5 | 154,0 | 187,8 | 3,33 | |
| C5H12 | Неопентан | 9,5 | 29,5 | 61,1 | 90,7 | 127,6 | 160,6 | 3,2 | |
| C5H12 | Пентан | 36,1 | 56,7 | 93,4 | 124,7 | 164,3 | 196,6 | 3,37 | |
| C5H12O | 1-Этоксипропан | 61,7 | 85,3 | 123,1 | 156,2 | 197,2 | 227,4 | 3,25 | |
| C6 | |||||||||
| C6H5Br | Бромбензол | 156,1 | 186,2 | 232,5 | 274,5 | 327,0 | 397 | 4,52 | |
| C6H5Cl | Хлорбензол | 131,7 | 160,2 | 205,0 | 245,3 | 292,8 | 359,2 | 4,52 | |
| C6H5F | Фторбензол | 85,1 | 109,9 | 148,5 | 184,4 | 227,6 | 286,6 | 4,52 | |
| C6H5I | Иодбензол | 188,3 | 220,0 | 270,0 | 315,7 | 371,5 | 448 | 4,52 | |
| C6H6 | Бензол | 80,1 | 104,4 | 143,3 | 178,8 | 221,5 | 289,5 | 4,92 | |
| C6H6O | Фенол | 181,8 | 208,0 | 248,2 | 283,8 | 328,7 | 400,0 | 419,2 | 6,13 |
| C6H7N | Анилин | 184,0 | 212,8 | 254,8 | 292,7 | 342,0 | 422,4 | 426 | 5,31 |
| C6H10O | Циклогексанон | 155,6 | 185 | 229 | 265 | 308 | 356 | 3,85 | |
| C6H12 | Метилциклопентан | 71,8 | 96,2 | 135,9 | 171,4 | 213,8 | 259,6 | 3,79 | |
| C6H12 | Циклогексан | 80,7 | 105,7 | 145,7 | 183,2 | 228,4 | 281,0 | 4,11 | |
| C6H12O | Циклогексанол | 161,0 | 188 | 230 | 266 | 308 | 352 | 3,75 | |
| C6H12O | 4-Метилпентан-2-он | 115,5 | 180,8 | 218,3 | 262,6 | ||||
| C6H12O2 | Этилизобутират | 110,1 | 135,5 | 174,2 | 210,0 | 253,0 | 280 | 3,04 | |
| C6H14 | Гексан | 68,7 | 92,6 | 131 | 167 | 209 | 234,7 | 3,03 | |
| C6H14 | 2,2-Диметилбутан | 49,7 | 73,2 | 111,2 | 145,6 | 186,7 | 216,2 | 3,11 | |
| C6H14 | 2,3-Диметилбутан | 58,0 | 81,8 | 120,3 | 155,7 | 198,7 | 227,1 | 3,13 | |
| C6H14 | 2-Метилпентан | 60,3 | 83,9 | 122,1 | 156,5 | 197,4 | 224,7 | 29,9 | |
| C6H14 | 3-Метилпентан | 63,3 | 87,1 | 125,4 | 160,1 | 201,3 | 231,5 | 3,12 | |
| C7 | |||||||||
| C7H6O | Бензальдегид | 179,0 | 212 | 256 | 298 | 348 | 352 | 2,18 | |
| C7H8 | Толуол | 110,6 | 137,0 | 179,0 | 215,8 | 262,5 | 320,8 | 4,22 | |
| C7H8O | Метоксибензол (анизол) | 155,5 | 184 | 224 | 265 | 312 | 369 | 4,18 | |
| C7H8O | о-Крезол | 190,9 | 220 | 263 | 303 | 352 | 422 | 5,01 | |
| C7H8O | м-Крезол | 202,2 | 232 | 276 | 317 | 366 | 426 | 4,8 | |
| C7H8O | п-Крезол | 201,9 | 230 | 274 | 315 | 362 | 426,0 | 4,66 | |
| C7H9N | о-Толуидин | 200,2 | 232 | 280 | 322 | 372 | 421 | 3,75 | |
| C7H9N | м-Толуидин | 203,4 | 233 | 281 | 322 | 372 | 436 | 4,15 | |
| C7H9N | п-Толуидин | 200,6 | 229,5 | 276 | 319 | 368 | 394 | 2,38 | |
| C7H14 | Метилциклогексан | 100,9 | 171,0 | 209,9 | 256,3 | ||||
| C7H14 | Этилциклопентан | 103,5 | 172,4 | 210,6 | 25,8 | ||||
| C7H16 | Гептан | 98,4 | 122,3 | 164,7 | 202,4 | 246,8 | 267,0 | 2,74 | |
| C8 | |||||||||
| C8H10 | Этилбензол | 136,2 | 164,0 | 208,5 | 246,3 | 294,5 | 346,4 | 3,75 | |
| C8H10 | о-Ксилол | 144,4 | 172,6 | 217,6 | 259 | 307 | 359,0 | 3,65 | |
| C8H10 | м-Ксилол | 139,1 | 167 | 211 | 253 | 303 | 346,0 | 3,55 | |
| C8H10 | п-Ксилол | 138,4 | 166 | 211 | 253 | 303 | 345,0 | 3,45 | |
| C8H10O | 2,4-Диметилфенол | 210,0 | 241 | 290 | 334 | 386 | (496,4) | (65) | |
| C8H10O | 3,4-Диметилфенол | 225 | 253 | 300 | 342 | 390 | (545) | (10,13) | |
| C8H10O | 3,5-Диметилфенол | 219,5 | 250 | 299 | 344 | 398 | (493) | (5,57) | |
| C8H18 | Октан | 125,7 | 150,9 | 195,6 | 235,3 | 281,5 | 296,7 | 2,49 | |
| C9 | |||||||||
| C9H7N | Хинолин | 237,7 | 270 | 322 | 369 | 424 | (527) | (5,78) | |
| C9H12 | Изопропилбензол (кумол) | 152,4 | 187 | 232 | 275 | 326 | 362,7 | 3,24 | |
| C9H12 | 1,2,4-Триметилбензол (псевдокумол) | 169,3 | 199 | 246 | 302 | 381,2 | 3,34 | ||
| C9H20 | Нонан | 150,8 | 177,2 | 224,0 | 265,5 | 313,6 | |||
| C10 | |||||||||
| C10H18 | цис-Декагидронафталин(цис-декалин) | 195,7 | 227 | 275 | 319 | 370 | 404 | 2,49 | |
| C10H22 | Декан | 174,1 | 204,3 | 274,7 | 319,1 | ||||
| C11 | |||||||||
| C11H24 | Ундекан | 195,9 | 224,3 | 274,7 | 319,1 | ||||
| C12 | |||||||||
| C12H10 | Бифенил | 255,5 | 292 | 345 | 398 | 454 | 496 | 3,12 | |
| C12H10O | Дифениловый эфир | 258,5 | 299 | 354 | 407 | (515) | (3,14) | ||
| C12H11N | N-Фениланилин | 302,0 | 339 | 397 | 445 | 499 | (658) | (8,41) | |
| C12H18 | 1,4-Диизопропилбензол | 210,4 | 241 | 287 | 328 | 374 | 449 | (521) | (9,78) |
| C12H26 | Додекан | 216,3 | 247,7 | 300,0 | 345,8 | 386 | 1,81 | ||
| C13 | |||||||||
| C13H12 | 1,1′-Метилендибензол | 264,3 | 298 | 353 | 401 | 460 | (572,5) | (5,98) | |
| Формула | Название | 0,101 МПа | 0,203 МПа | 0,507 МПа | 1,013 МПа | 2,027 МПа | 5,066 МПа | Критическая температура, °С | Критическое давление, МПа |
| Температура кипения или возгонки при давлении насыщенного пара | |||||||||
Примечание. Недостаточно надежные данные заключены в скобки.
Когда в садик можно не идти?
Для школьников Министерством образования и каждым отдельно взятым образовательным учреждением вырабатываются нормативы и принимаются решения об отмене занятий в случае превышения определенных температурных ограничений.
Для детских садов подобная практика отсутствует. То есть детские садики не закрывают не при какой температуре, учреждение работают при любых погодных условиях.
Решение о посещении родители принимают самостоятельно, руководствуясь собственными возможностями и пожеланиями. Вместе с тем, существует несколько рекомендаций о том, при каких условиях лучше не водить ребенка в сад и не ходить гулять.
Полезные советы представлены ниже:
- Педиатры советуют воздержаться от длительного пребывания на улице при температуре ниже -15ºС детям до трех лет и ниже -20ºС детям постарше.
- В том случае, когда родители решили оставить малыша дома, рекомендуется предупредить воспитателя о его отсутствии. В противном случае, ребенок не будет исключен из списка для расчета суточного питания, следовательно, сумма не будет исключена из ежемесячной квитанции.
- Отсутствие в детском саду в течение более чем 5 дней (выходные и праздничные дни не входят в период), повлечет за собой необходимость предоставления справки от педиатра о состоянии здоровья ребенка.
- В том случае, если малыш идет в детский сад необходимо позаботится о том, чтобы одеть его потеплее. Так, врачи советуют надевать несколько предметов одежды, создавая многослойность. Это обеспечит присутствие воздуха между слоями, а он сохранит тепло.
- Если ребенок едет до садика в автомобиле или автобусе, нужно постараться не допустить перегрева. В противном случае малыш выйдет на мороз потным, что может привести к переохлаждению и заболеванию.
К сожалению, на территории РФ отсутствует документ, четко устанавливающий правила проведения прогулок дошкольников в детских садах. Однако не стоит забывать, что воспитатели выходят на улицу вместе с ребятами и способны вполне адекватно оценить возможность и продолжительность проведения времени на свежем воздухе.