Теоретическая тарелка — устройство, количество, расчет
Внутри классической колонны есть плоские горизонтальные контактные элементы, которые очень напоминают тарелки. На поверхности этих элементов происходит тепломассообмен между флегмой и парами и разделение фракций. Или, если проще, пузырьки пара проходит через слой флегмы на тарелке. Чем больше количество тарелок и площадь контакта, тем лучше разделяющая способность колонны. В поисках способа измерить эту способность и была придумана теоретическая тарелка (ТТ).
Что такое теоретическая тарелка?
Это удобный термин, созданный для измерения разделяющей способности колонны. Теоретическая тарелка — это модель обмена теплом и массой в парожидкостной среде. Модель основана на представлении колонны идеальным изолированным устройством, со 100-процентной разделяющей способностью, на которую не влияют внешние факторы. Колонна как будто находится в непрерывном термодинамическом равновесии.
Теоретические тарелки нужны, как удобное понятие, от которого отталкиваются при расчетах.
Даже если в колонне не тарелки, а спирально-призматическая насадка (СПН), она все равно обладает разделяющей способностью, которая может быть измерена при помощи теоретической тарелки.
Можно пояснить по-другому. Из водно-спиртовой смеси крепостью 10% можно получить простой перегонкой спирт крепостью 40%. При последующих перегонках мы получим, соответственно, спирт крепостью 60, 70, 80, 90, 96%. Каждая физическая перегонка с повышением крепости продукта считается теоретической тарелкой или единицей массопереноса. Всего таких перегонок нужно около 10. То есть, ректификация — это 10 последовательных дистилляций, которые идут параллельно на разных тарелках.
Итак, КПД теоретической тарелки всегда 100%. Этим она и отличается от физической тарелки.
Теоретические тарелки в ректификационных колоннах
Теоретическая тарелка в ректификации — это часть колонны, в которой при конкретных условиях и режиме работы колонны достигается равновесие жидкой и парообразной фаз и теплообмен прекращается. Самой маленькой эта часть будет, когда колонна работает “на себя”, без отбора — с СПН она составит всего 1,5-3 см. При отборе голов и хвостов — 2-4 см, тела — 6-8 см.
Число теоретических тарелок в ректификационной колонне
В зависимости от числа флегмы и спиртуозности жидкости в кубе, меняется количество теоретических тарелок одной и той же колонны. Если при работе “на себя” в ней будет около 100 ТТ, то при отборе тела — 10-40 ТТ, поскольку флегмы будет много.
Конструкция тарелок ректификационной колонны
Устройство тарелок ректификационной колонны может быть самым разнообразным, но самый простой, эффективный и популярный вариант насадки в бытовой колонне — это СПН.
Контактный элемент колпачковых колонн.
Ситчатые тарелки.
Решетчатые тарелки.
Клапанные тарелки.
Тарелки с S-образными контактными элементами.
Встречаются и смешанные модификации, например, ситчато-клапанные.
Подробнее об этих контактных элементах читайте в нашем материале “Виды тарелок в ректификационной колонне”.
Расчет числа теоретических тарелок в ректификационной колонне
Расчет теоретических тарелок, по идее, нужно производить при помощи программ, он слишком сложен. И все же существуют формулы, по которым можно рассчитать число теоретических тарелок, например — на основе разницы температур:
nth = (T2 +T1) / (K (T2-T1)) , где Т1 — температура кипения спирта; Т2 — температура кипения воды; K — константа, которая может быть равна 2,5 — максимальное число ТТ, 3 — оптимальное, 4 — минимальное число ТТ.
Эта формула не учитывает флегмово число, давление и задержку жидкости.
Метод определения числа теоретических тарелок
Все методы делятся на аналитические и графические, все достаточно сложны. Графические предполагают построение фазовой диаграммы или ступенчатых графиков из кривой равновесия, вертикальных и горизонтальных линий. Количество полученных на графике “ступеней” соответствует количеству теоретических тарелок. Вертикальные линии — это дельта, изменение концентрации паров над тарелкой, горизонтальные — дельта концентрации конденсата на ее поверхности. Чем больше флегмово число, тем меньше нужно тарелок.
Из-за несовершенства методов расчета нередко число теоретических тарелок приходится увеличивать. Кроме того, методы не учитывают брызгоунос с тарелки на тарелку, расстояние между ними и другие факторы. Желательно при расчетах использовать калькулятор.
А теперь — вопросы, которые наверняка уже возникли.
Сколько теоретических тарелок нужно для получения дистиллята?
Труба без насадок и диаметром 3 см как бы равна теоретической тарелке высотой 25 см. Если ее заполнить СПН, высота ее теоретической тарелки составит 25 мм. То есть, увеличится площадь контакта и качество разделения в 10 раз.
Количество теоретических тарелок, достаточное для получения плохо очищенный спирт крепостью 96о составляет 10 штук. Питьевой спирт приличного качества можно получить, если колонна разделяет, как 30-50 теоретических тарелок. И более 100 нужно, чтобы получить спирт высокой очистки, близкий к категории “Люкс”.
Но есть еще и физические тарелки (насадки, не суть важно). Одна ТТ = 2 ФТ. Следовательно, колонна должна содержать 200 ФТ, чтобы давать спирт высокой очистки.
Как рассчитать высоту теоретической тарелки?
Как рассчитать теоретическую тарелку точно? Посредством калькулятора определения числа ТТ, например, вот такого.
Как рассчитать высоту, эквивалентную теоретической тарелке?
Согласно вышеизложенному.
И конечно же, выбирайте современную колонну с длинной царгой, заполненной мочалкой или СПН, у которых очень большая площадь контакта и разделяющая способность.
Примером такой колонный может служить Luxstahl 8.
Что такое “теоретическая тарелка” и сколько их нужно.
Р е к т и ф и к а ц и я
Даже при многократной перегонке, самогон так и останется самогоном, хотя его качество в некоторой степени улучшится. Причин тому несколько. В состав самогона в зависимости от исходного сырья и технологии изготовления, может входить до 70 компонентов с различными физико-химическими свойствами. Некоторые из них невозможно отделить очисткой и повторными перегонками (азеотропы). Они так и остаются в самогоне. Естественно возникает вопрос, возможно ли в домашних условиях получить крепкий алкогольный продукт, хорошего качества? И ответ на это вопрос есть. Это перегонка домашнего самогона с использованием ректификационной колонны. Ректификация позволяет получить спирт 96%, наивысшей степени очистки и избавиться от неприятного вкуса и запаха.
Многие ошибочно считают, что ректификация это повторная перегонка. Поэтому хочу заострить ваше внимание на том, что ректификация — это совершенно иной по природе процесс. Процесс ректификации основан на взаимодействии потоков жидкости и пара.
При нагревании емкости со спиртосодержащей жидкостью (самогон), жидкость начинает кипеть. Образуются пары. Пары начинают подниматься по ректификационной колонне вверх и попадают в дефлегматор. Дефлегматор охлаждается водой. Пар, достигнув холодной поверхности дефлегматора, начинает конденсироваться. Сконденсировавшийся пар — флегма, стекает по стенкам дефлегматора и далее по колонне вниз. Колонна заполнена контактными элементами насадкой. Поднимающийся вверх пар и стекающая вниз флегма начинают контактировать между собой на поверхности насадки, и происходит процесс тепломассобмена. В основу ректификации заложен непрерывный обмен между жидкостью и паром. При этом происходит многократная конденсация пара и испарение жидкости, на контактных элементах колонны. Жидкая фаза насыщается более высококипящим компонентом, а паровая фаза — более низкокипящим. Процесс тепломассообмена происходит по всей высоте колонны между стекающей вниз флегмой образующейся в дефлегматоре, и поднимающимся вверх паром из куба. В результате тепломассообмена между флегмой и паром в верхней части колонны накапливается самый легкокипящий компонент, что содержится в спиртосодержащей жидкости, часть которого затем отводится в конденсер для конденсации и виде дистиллята обирается в приемную емкость. Жидкость и пар в любой точке колонны находятся в состоянии фазового равновесия.
Принцип работы насадочной колонны проиллюстрирован на этой схеме.
Таким образом, весь этот процесс можно сформулировать в небольшом предложении. Ректификация — это многократная перегонка дистиллята, осуществляемая в противоточных тарелочных или насадочных колоннах с контактными элементами (насадка, тарелки).
Для успешного взаимодействия флегмы, стекающей вниз по колонне, и пара, движущегося вверх, можно использовать любые контактные элементы, увеличивающие площадь и эффективность их взаимодействия. В качестве контактных элементов в больших ректификационных колоннах обычно используются тарелки. Каждая такая тарелка, расположенная в колонне, называется физической тарелкой (ФТ). Ее назначение — обеспечить быстрое достижение состояния равновесия между жидкой и паровой фазами. Тарелки работают следующим образом. Пар в виде пузырьков с развитой поверхностью пробулькивает через слой флегмы, находящейся на тарелке. В результате массообмен между фазами интенсифицируется. Однако, при проходе пара только через одну тарелку полное равновесие между фазами еще не достигается. Фактическое состояния паровой и жидкой фаз по отношению к их равновесному состоянию оценивается коэффициентом полезного действия тарелки. КПД классических тарелок составляет 50…60%. Т.е. для достижения состояния равновесия фаз, соответствующего одной теоретической тарелке, потребуется около двух физических. Таким образом, для реализации в ректификационной колонне 40 ТТ потребуется установить в ней порядка 80 физических тарелок классической конструкции.
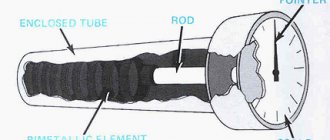
Для домашних ректификационных колонн диаметром 30-50 мм эффективным контактным элементом является насадка, заполняющая собой весь внутренний объём колонны. При работе колонны вниз по контактному наполнителю стекает дистиллят, а вверх поднимается пар. В ректификационных колоннах промышленного изготовления используются насадки типа «Зульцер» из гофрированной нержавеющей сетки или спирально-призматические в виде мелких пружинок из нержавеющей проволоки. Тепломассообмен на таких контактных элементах проходит непрерывно по всей высоте колонны, а состояние фазового равновесия, эквивалентное одной теоретической тарелке (ТТ), наступает после преодоления паром некоторого слоя насадки, высоту которого называют высотой единицы переноса (ВЕП) или высотой теоретической тарелки (ВТТ). Эту высоту оценивают в миллиметрах, что позволяет рассчитывать высоту ректификационной части колонны. Поэтому в дальнейшем при изготовлении оборудования для домашней ректификации, речь пойдет в основном о колоннах диаметром от 30 до 50 мм, с использованием насадочных контактных элементов.
| 2. Теплофизические свойства водно-спиртовых растворов. Свойства абсолютизированного 100% этилового спирта (ЭС) с практической точки зрения мало интересны (tкип=78,3°C при 760мм.рт.ст., ρ=790κг/м3). Поэтому, здесь мы разберемся со свойствами бинарной (двойной) смеси ЭС + вода, дающими полное представление о работе ректификационного оборудования и получения на нем этилового спирта-ректификата. 2.1 Концентрация спирта. Всем известно, что ЭС очень хорошо растворяется в воде образуя бинарную водно-спиртовая смесь (раствор), которая может содержать в себе любое количество спирта. В случае использования тех или иных справочных данных необходимо четко различать два понятия концентрации спирта в водно-спиртовом растворе – массовая и объемная концентрации. Массовая концентрация спирта используется только для физических расчетов, анализа процессов горения и др. Массовая концентрация — это масса спирта в массе раствора ( обозначается как % масс. , или кг/кг, или г/г). Чаще и традиционно используется понятие объемной концентрации спирта – это объем спирта в объеме раствора (обозначается как % об. , или м3/м3 , или л/л , или мл/мл). Эта некоторая “путаница” в концентрациях возникает из-за разной плотности спирта (ρ=790κг/м3=0,79г/мл) и воды (ρ=1000κг/м3=1г/мл). Разница в цифрах объемной и массовой концентраций одного и того же раствора существенна, поэтому далее мы будем пользоваться только понятием объемной концентрацией спирта. Для определения объемного содержания спирта в растворе — концентрации спирта в жидкости (X) используются специальные спиртометры: АСП-3 0…40%, АСП-3 40…70%, АСП-3 70…100%, АСП 95…105%, АСП-2 96…101%, с термометром АСПТ 60…100%. Стоит отметить, что плотность водно-спиртового раствора сильно зависит от его температуры, а все эти приборы измеряют именно плотность раствора (используют силу Архимеда). Поэтому реальное содержание спирта в растворе совпадает с показаниями этих приборов только при 20ºC, что и указано на шкалах этих приборов. Наиболее известными растворами являются водка – 40% и спирт-ректификат – 96,4%. Кстати, содержание спирта в бражке находится в пределах 7…12%, но измерять эту концентрацию с помощью спиртометров нельзя из-за наличия в бражке остаточного сахара и других примесей, влияющих на плотность раствора, и соответственно, искажающих показания прибора. Пары ЭС также хорошо растворяются и в парах воды и образуют с ними единую паровую смесь с концентрацией спирта в них Y, которую можно определить только после конденсации этих паров – т.е. в жидкости (как в предыдущем случае) или по температуре их парообразования при 760мм.рт.ст. (см. ниже). 2.2 Температура кипения водно-спиртовой смеси. Естественно, температура кипения раствора двух веществ — воды (tкип=100°C при 760мм.рт.ст) и этанола (tкип=78,3°C при 760мм.рт.ст) должна находится между температурами кипения индивидуальных веществ. Зависимость температуры насыщенного водно-спиртового пара или температура кипения (парообразования) этой бинарной смеси от концентрации спирта в парах Y представлена на рис.1. Стоит обратить внимание, что на этом графике существует некоторая точка Ас концентрацией 96,4% температура в которой даже меньше температуры кипения 100%-го этанола. Рис.1 Температура насыщенного водно-спиртового пара или температура кипения водно-спиртовой смеси ( при давлении 760 мм рт.ст.) 2.3 Равновесие фаз. Равновесным состоянием фаз (жидкой и парообразной) называется такое их сосуществование, при котором не происходит никаких видимых качественных или количественных изменений этих фаз. Равновесие фаз считается достигнутым только в том случае, когда одновременно удовлетворяются два условия: равны температуры фаз и равны парциальные давления каждого компонента в паровой и жидкой фазах. Второе условие означает, что процесс перехода через границу раздела фаз каждого компонента из жидкой фазы в паровую фазу и обратно завершен. Т.е. составы жидкой и паровой фазы стабилизировались, а концентрации компонентов в отдельно взятой фазе одинаковы в каждой точке ее объема. Для бинарной водно-спиртовой смеси это теоретическое высказывание означает очень простую вещь. Если в обычную колбочку (схематично нарисована внутри графика рис.2) налить небольшое количество водно-спиртовой смеси с концентрацией Xж и нагреть до температуры кипения этой смеси, то в образовавшемся паре концентрация спирта будет Yп. Затем, если быстро закрыть колбочку и интенсивно встряхнуть (перемешать паровую и жидкостную фазы), то температура внутри колбочки выровняется, а пар и жидкость придут в равновесное состояние – с концентрациями в них спирта Y иX соответственно. Если такие опыты провести для разных концентраций водно-спиртовых растворов, то можно получить некоторую зависимость равновесия фаз – кривая равновесия фаз. График кривой равновесия фаз для бинарной смеси чистый спирт + чистая вода представлен на рис.2. Рис.2 Кривая равновесия фаз бинарной водно-спиртовой смеси (при давлении 760 мм рт.ст.) Теоретическая и практическая значимость кривой равновесия фаз с точки зрения процесса ректификации спирта очень велика, но к этому мы вернемся позднее в разделе “Ректификация”, а сейчас покажем, как этой кривой пользоваться. Например, при обычной перегонке бражки с концентрацией спирта X=10%образуется пар с концентрацией в нем спиртаY=42%, а после его конденсации мы получаем “самогон” (конденсат, дистиллят) той же “крепости”. Таким образом, если самогонный аппарат не снабжен какими-нибудь дополнительными “прибамбасами”, то получить более крепкий самогон таким способом теоретически просто невозможно. Таким же образом можно “предугадать” с помощью той же кривой и результат повторной перегонки “первача” — из 40%-го дистиллята второй перегонкой можно получить 60%-ый “самогон”. Рассматривая этот график, стоит обратить внимание на диагональ Y=X. Именно благодаря тому, что почти вся кривая равновесия лежит выше этой диагонали, можно при испарении водно-спиртовой смеси получать концентрацию спирта в парах большую, чем его концентрация в исходной жидкости. Исключением является только точка А — пересечение кривой равновесия с диагональю, где X=Y=96,4%.Это особая точка азеотропы. Азеотропными или нераздельно кипящими называют смеси, у которых пар, находящийся в равновесии с жидкостью, имеет тот же состав, что и жидкая смесь (X=Y). При перегонке азеотропных смесей образуется конденсат того же состава, что и исходная смесь. Разделение таких смесей перегонкой и ректификацией исключается. Водно-спиртовая смесь в особой точке азеотропы называется “этиловый спирт-ректификат (СР)”. Именно к этой точке стремится процесс ректификации, именно она является предельной концентрацией спирта в этом процессе, и именно в этой точке водно-спиртовая смесь имеет минимальную температуру кипения (tкип=78,15°C при 760мм.рт.ст. см. рис.1). 2.4 Основные свойства спирта-ректификата На этот продукт существует ГОСТ 5962-67, в котором регламентируется концентрация спирта в спирте-ректификате от 96% до 96,4% и его состав. Приведем некоторые физические свойства этилового спирта-ректификата Плотность жидкости (при 20ºС)…………….……….…. 812 кг/м3 (≈0.8кг/л) Плотность паров (при 760 мм.рт.ст.)………….……….. 1,601 кг/м3 Температура кипения (при 760 мм.рт.ст)……………… 78,15 ºC Удельная теплота парообразования……………………. 925 кДж/кг Эти данные являются основой при проектировании спиртового ректификационного оборудования. А для Вас будут являться обычной справочной информацией. 2.5 Температура кипения спирта-ректификата и атмосферное давление. Стоит отметить, что температура кипения СР существенным образом зависит от атмосферного давления. Причем эта зависимость настолько сильная (см. рис.3), что при ректификации спирта по температуре, регистрируемой, например, электронным термометром, можно определить точное значение атмосферного давления в данный момент и проградуировать обычный домашний барометр, пользуясь приведенной ниже зависимостью. Рис.3 Зависимость температуры кипения этилового спирта-ректификата от атмосферного давления Если Вы эксплуатируете ректификационную установку без термометра, то эта информация просто расширяет Ваш кругозор и не имеет для Вас никакого практического значения, поскольку момент выхода СР Вы с абсолютной точностью определяете по запаху. Но, для тех, кто приобрел установку с электронным термометром, эта связь температуры кипения спирта с атмосферным давлением имеет непосредственное практическое значение. Действительно, имея профессиональное ректификационное оборудование и электронный термометр, способный с высокой точностью определять температуру спиртовых паров, Вы с удивлением можете обнаружить, что его показания отличаются изо дня в день. Если вчера Вы наблюдали температуру кипения спирта 77,0ºC, а сегодня – 78,0ºC, то это означает не изменение спиртового состава или неисправность ректификационного устройства, а всего лишь изменение атмосферного давления: вчера было — 730мм.рт.ст., а сегодня – 755мм.рт.ст. 3. Теория и практика простой перегонки бражки. Простая перегонка (дистилляция) – процесс, при котором происходит однократное испарение наиболее летучих компонентов из кубовой жидкости и однократная конденсация этих паров. 3.1 Цель простой перегонки Содержание спирта в бражке очень мало от 6 до 12%. Однако, для получения высококачественного спирта путем ректификации требуется более концентрированный спиртовой раствор, поэтому для получения спирта-рекитификата на всех спиртовых заводах производят первоначальное, грубое отделение спирта от воды, в результате которого получают спирт-сырец (СС), а затем проводят его ректификацию. Такой же путь можно рекомендовать для домашней технологии приготовления спирта. Перегонку бражки можно проводить и с помощью ректификационного оборудования (см. ниже). Используя при перегонке бражки ту же технику ректификации, можно из бражки сразу получить 80…85% -ый СС. Но это не нужно, поскольку для четкой ректификации СС, его все равно необходимо будет разбавить до концентрации 40%. Более того, перегоняя бражку на ректификационном устройстве, очень часто пеной засоряется нижняя часть колонны. Для более эффективного использования ректификационной колонны, все таки на ней лучше проводить ректификацию, а 40%-ый самогон можно успешно получать из бражки с помощью простейшего перегонного аппарата. 3.2 Оборудование для простой перегонки Принципиальная схема простого дистиллятора представлена на рис.4. Дистиллятор состоит из испарительной емкости – куба 1 и конденсатора-охладителя 2, которые соединены между собой патрубком 3. Куб заполнен перерабатываемой жидкостью 4, нагрев и испарение которой осуществляется нагревателем 5. Через конденсатор-охладитель постоянно протекает охлаждающая вода (показана стрелочками). Для удобства работы с дистиллятором в крышке куба может быть установлен термометр 6, который регистрирует температуру паров направляющихся на конденсацию. Приемная емкость 7. 3.3 Работа аппарата простой перегонки Дистиллятор работает следующим образом. С помощью нагревателя кубовая жидкость доводится до кипения. Образовавшийся в кубе пар по патрубку попадает в конденсатор-охладитель, где происходит его конденсация и охлаждение. Полученный дистиллят стекает в приемную емкость 7. Что касается дистилляции спирта, то при работе этого устройства, процесс получения дистиллята в основном подчиняется приведенной выше кривой фазового равновесия (рис.2). Причем в начальный момент, когда концентрация спирта в растворе велика (в бражке она составляет 10…12%), велика и концентрация спирта в парах, а следовательно, и в его дистилляте (42…45%). Однако, бражка не является бинарной смесью воды и спирта, а содержит большое количество попутных примесей с меньшей и большей температурой кипения по отношению к водно-спиртовой смеси. Температура паров спирто-водяной смеси, проходящей в этот момент по патрубку, составляет величину порядка 90…94°С, но легкокипящие примеси (эфиры, ацетоны, альдегиды, метиловый спирт и др.) в большей доле входят в состав первоначального пара, понижая эту теоретическую температуру до 65…75°C. Увеличенная концентрация легкокипящих примесей (плотность которых меньше плотности спирта) в первоначальном дистилляте искажает показания спиртомера в большую сторону, создавая иллюзию повышенной “крепости”. Именно поэтому первая порция дистиллята, полученная из бражки, называется “первачём”. В действительности это не концентрированный спирт, а водно-спиртовая смесь с повышенной концентрацией “отравы”. На следующем этапе перегонки изменение температуры в большей степени соответствует теории. Используя показания термометра 6 и пользуясь графиком рис.1, можно всегда знать концентрацию паров спирта Y, идущих на конденсацию. Постепенно концентрация спирта в кубе уменьшается, соответственно уменьшается и его концентрация в дистилляте, что отмечается увеличением температуры на термометре 6. Если температура достигла 100°С, то это означает, что спирт в кубовой жидкости полностью закончился и из куба испаряется только вода. Несмотря на то, что вблизи нулевой точки (рис.2) концентрация спирта в парах в 8 раз больше его концентрации в жидкости, процесс перегонки обычно завершают при температуре пара 97…98°C. Это связано с тем, что с этого момента начинается более интенсивное испарение сивушных масел и других хвостовых примесей. Средняя концентрация спирта в дистилляте (типичный “самогон”), получаемого из бражки с помощью аппаратов простой перегонки, обычно не превышает 40%. Типовой график изменения температуры по времени при простой дистилляции схематично представлен на рис.5. Рис.5 Изменение температуры паров при простой перегонке Можно повторно провести перегонку уже 40%-го дистиллята и получить более концентрированный ≈ 60% раствор спирта (см. рис.2). Затем можно многократно повторять этот процесс до получения концентрации спирта в дистилляте около 90…94%. Однако, стоит сразу обратить Ваше внимание на то, что полученный таким образом “спирт” будет содержать все примеси изначально содержащиеся в бражке. Это означает, что после разбавления такого “спирта” водой до 40% Вы получите все тот же “самогон”, что и после первой перегонки. При таком способе извлечения спирта из бражки с целью получения качественной водки требуются сложные, порой очень дорогостоящие и протекающие с большими потерями спирта и электроэнергии каскады очисток и повторных перегонок. Именно поэтому этот путь получения качественной водки давно отошел в историю! В настоящий момент существует другой, более простой способ получения высококачественной водки, суть которого, заключается в получении из СС (“самогона”) сразу 96%-го спирта-ректификата, очищенного от примесей, а затем разбавлении его хорошей водой до концентрации водочного раствора. Этот способ требует специального и достаточно сложного ректификационного оборудования. 4. Теория ректификации Ректификация – тепломассообменный процесс, который осуществляется в противоточных колонных аппаратах с контактными элементами (насадка, тарелки). В процессе ректификации происходит непрерывный обмен между жидкой и паровой фазой. Жидкая фаза обогащается более высококипящим компонентом, а паровая фаза – более низкокипящим. Процесс тепломассообмена происходит по всей высоте колонны между стекающим вниз дистиллятом , образующимся наверху колонны (флегмой), и поднимающимся вверх паром. Чтобы интенсифицировать процесс тепломассообмена применяют контактные элементы, увеличивающие поверхность взаимодействия фаз. В случае применения насадки, флегма стекает тонкой пленкой по ее развитой поверхности. В случае применения тарелок, пар в виде множества пузырьков, образующих развитую поверхность контакта, проходит через слой жидкости на тарелке. 4.1 Цель ректификации Целью ректификации вообще является чёткое разделение жидких смесей на отдельные чистые компоненты. При ректификации спирта основная задача — из 40%-го СС получить СР с концентрацией в нем ЭС не менее 96% при минимальным содержании посторонних примесей. Для этого процесс ректификации СС проводят за один раз на специальном ректификационном оборудовании. Это оборудование позволяет разделять водно-спиртовую смесь на отдельные азеотропные фракции, отличающиеся температурами кипения. Одной из таких фракций является пищевой спирт-ректификат. 4.2 Оборудование для ректификации В промышленности применяются ректификационные установки непрерывного действия. В этих установках 85%-ый СС и перегретый водяной пар смешиваются в нижней части колонны и превращаются в ≈ 40%-ый водно-спиртовой насыщенный пар при температуре ≈ 94°C (см. рис.1). Эта паровая смесь непрерывно поступает в ректификационную колонну, расслаивается по ее высоте на отдельные фракции, которые непрерывно и с определенным темпом отбираются из разных частей колонны. Для обеспечения нормальной работы таких непрерывных колонн требуются достаточно сложные и дорогие элементы автоматики. В химических и физических лабораториях обычно применяют ректификационные колонны периодического действия, не требующие никакой автоматики. Эти колоны оборудованы только элементарными средствами регулировки отбора, температурного контроля и манометрическим измерителем перепада давления на колонне. Принципиальная схема периодической ректификационной установки представлена на рис.6. Установка состоит из испарительной емкости – куба 1 и ректификационной колонны, установленной вертикально на крышке куба. Куб заполнен перерабатываемой жидкостью 4, нагрев и испарение которой осуществляется нагревателем 5. Колонна включает в себя ректификационную часть 9 и головку колонны 10. Ректификационная часть колонны представляет собой трубу 11, покрытую снаружи теплоизоляцией 12 и заполненную внутри контактными элементами 13. Головка колонны представляет собой систему патрубков 3 к которой в соответствии со схемой подсоединены: термометр 6, конденсатор 2, охладитель 14 и регулятор отбора 15. Внизу ректификационной части колонны обычно монтируется манометрическая трубочка 16 для измерения перепада давления в колонне. Через охладитель 14 и конденсатор 2 постоянно протекает охлаждающая вода. 4.3 Работа ректификационной колонны. Ректификационная установка работает следующим образом. С помощью нагревателя кубовая жидкость доводится до кипения. Образующийся в кубе пар по ректификационной части колонны 9 поднимается вверх и попадает в конденсатор 2, где происходит его полная конденсация. Часть этого конденсата (флегмы) возвращается в ректификационную часть колонны, а другая часть проходит через охладитель 14 и в виде дистиллята 7 стекает в приемную емкость 8. Соотношение между расходами флегмы и отбираемого дистиллята называется флегмовым числом и устанавливается с помощью регулятора отбора 15. По всей высоте ректификационной части колонны происходит процесс тепломассообмена между стекающей вниз флегмой и поднимающимся вверх паром. В результате этого в головке колонны накапливается в виде пара и флегмы самый легкокипящий (с наименьшей температурой кипения) компонент кубовой жидкости, а следом за ним сама собой выстраивается “номерная очередь” (вниз по высоте колонны ) из разных веществ. “Номером” в этой очереди является температура кипения каждого компонента, возрастающая по мере опускания по колонне. С помощью регулятора 15 осуществляется медленный и последовательный отбор этих веществ в соответствии с их очередностью. “Номер” отбираемого в каждый момент вещества регистрируется с помощью термометра 6. Зная эту температуру с учетом атмосферного давления, можно достаточно точно указать основное вещество дистиллята, отбираемое в данный момент времени. Для пояснения приведем простейший и наглядный пример лабораторной ректификации. Нальем в испарительную емкость ацетон (20мл), метиловый спирт (30мл), этиловый спирт (50мл) и воду (100мл). Общее количество кубовой жидкости составит 200мл. Проведем ректификацию с записью текущей температуры и текущего объема получаемого дистиллята 7. Общий объем отобранного дистиллята доведем до 120мл, при этом остаток кубовой жидкости (воды) составит 80мл. По записям построим график изменения температуры от текущего объема дистиллята рис.7. На графике отчетливо видны четыре горизонтальных участка α (tк=const) и три переходных участка β между ними. Участки α– это индивидуальные чистые компоненты исходной смеси, а переходные участки β – это промежуточные вещества, состоящие из смеси двух чистых соседних компонентов. Пусть процесс ректификации проходил при атмосферном давлении 760мм.рт.ст., тогда по “высоте” и “длине” каждой ступеньки можно легко сделать вывод о качественном и количественном составе исходной смеси: | tк | Кол-во мл | Кол-во % |
| ацетон | 56.2 | 16.7 | |
| метиловый спирт | 64.7 | 25.0 | |
| этиловый спирт | 78.1 | 41.7 | |
| вода | 20+80 | 16.7 |
В процессе ректификации каждые индивидуальные и промежуточные вещества можно отбирать в отдельные приемные емкости 8, что позволяет не только провести качественный и количественный анализ исходной смеси, но и получить все ее компоненты раздельно. Рис.7 Изменение температуры при ректификации 4-х компонентной жидкости
Подготовка колонны к работе.
а) Соберите ректификационную установку так, как указано в ее паспорте. б) Для дистилляции заполните испарительную ёмкость на 2/3 своего объема бражкой, если перегонку проводите с помощью ректификационной колонны. Для ректификации заполните испарительную ёмкость на 3/4 своего объема спиртом-сырцом, при крепости не более 35-45%. в) Перекройте отбор. г) Проверьте герметичность сборки. д) Включите поток охлаждающей воды. е) Включите нагрев кубовой жидкости. Полное время подготовки колонны к работе занимает обычно не более 5-20 мин и зависит от, навыка и готовности всего оборудования к работе (места подключения установки к электросети и сети водяного охлаждения).
Процесс ректификации.
Процесс ректификации контролируется и регулируется по показанию термометра. Типовая зависимость изменения температуры t по времени представлена на рис.9, с указанием пяти периодов:
| Обоз-ние | Название периода ректификации | Мощность | Отбор |
| А | нагревание | Wу | Е=0 |
| Б | стабилизация | Wу | Е=0 |
| В | отбор головных фракций | Wт | 30% от Еном |
| Г | отбор фракции пищевого спирта | Wт | Еном |
| Д | отбор хвостовых фракций (остатка) | Wт | Еном |
Рис.9 Изменение температуры при ректификации спирта.
А) Нагревание.
СС в испарительной емкости нагревается всеми установленнми в ней ТЭНами суммарной мощности – Wу. Через некоторое время СС в кубе закипает, и начинается постепенный прогрев колонны поднимающимся вверх паром. В этот момент необходимо сразу перейти на технологическую мощностьWт, указанную в паспорте установки. Если такое переключение не произвести, то через несколько секунд колонна захлебывается. ПОМНИТЕ, что в этом состоянии колонна может находиться не более 30-60 секунд, иначе произойдет переполнение колонны и дефлегматора дистиллятом и начнется его аварийный сброс через верхний штуцер дефлегматора наружу. Если Вы всё же упустили момент начала кипения, и колонна захлебнулась, то Вам придется смириться с потерями спирта, и выключить колонну. Затем дождитесь прекращения процесса захлебывания и включите Wт. После прогрева колонны наблюдается скачок температуры, отмечаемый термометром.
Б) Стабилизация.
Колонна работает на технологической мощностиWт. Отбор перекрыт Е=0. Колонна работает сама на себя, флегмовое число V=∞. Наблюдая показания термометра, дождитесь уменьшения температуры и ее стабилизации на самом минимальном уровне. В этот момент проходит процесс разделения и накопления головных (легкокипящих) фракций в верхней части колонны. Через 10-15 минут этот процесс завершается, и температура в верхней части колонны достигает своего минимального значения и стабилизируется на 3-5˚С ниже ожидаемой температуры кипения СР. Величина этой разницы зависит от состава и количества легкокипящих фракций, находящихся в СС. Ожидаемую температуру кипения СР tс можно определить по атмосферному давлению в данный момент с помощью графика на рис.3. Если у Вас нет термометра, то просто дайте колонне поработать самой на себя 15 минут. Если этот процесс затянется на большее время, то это будет только лучше. Вы точнее сможете отделить все головные примеси, накопившиеся к этому моменту в колонне. Если Вы работаете с электронным компаратором температур, то можно более точно определить момент окончания стабилизации колонны по разности температур.
В) Отбор головных фракций.
Отбор головных фракций необходимо проводить как можно медленнее (с большим флегмовым числом). Медленный отбор не “размазывает” фракцию по колонне и не захватывает с собой следующие за ней фракции. Ввиду малого количества, но большого разнообразия веществ в головной фракции, эта часть дистиллята фактически является одним большим переходным участком ( βна рис.7 ) от множества головных примесей к чистому СР. Для правильной организации отбора на этом сложном периоде ректификации можно рекомендовать следующий подход , состоящий в разбивке этапа “В”,на следующие друг за другом три равных по времени промежутка.
| Промежуток“В” | Длительность | Отбор | ||
| % | мин | % | мл/ч | мл/мин |
| начальный | 10%Еном | 1,66 | ||
| средний | 30%Еном | |||
| переходной | 50%Еном | 500& | 8,3 |
Такая схема организации отбора головных фракций гарантирует Вам:
- полное выделение головных фракций из куба, и их полное отсутствие в следующей за ними пищевой фракции СР;
- минимальный объем головной фракции и отсутствие в ней пищевой фракции СР;
- подход к основной фракции СР с малой 50% -ой производительностью.
Этот период завершается достижением температуры, на 0,1-0.05˚С меньшей tс. Условно считается, что количество легкокипящих примесей, находящихся в этот момент в СР и вызывающих такое понижение температуры кипения СР, соответствует допустимым пищевым нормам. На практике самым точным прибором для принятия решения об окончании периода отбора головных фракций и начала отбора пищевого СР является обычный “человеческий нос”. Контроль получаемого дистиллята по запаху проводят следующим образом:
- накапайте несколько капель отбираемого дистиллята на ладонь;
- разотрите эту лужицу по всей поверхности ладони;
- поднесите ладонь к лицу и вдохните носом испарившийся с ладони дистиллят.
Такой мгновенный и достаточно точный анализ всегда будет Вам некоторым подспорьем при ректификации спирта. Общее количество головных фракций, полученных за этот период, составляет 1…3% от ожидаемого количества спирта и зависит от качества исходного сырья. СЛЕДУЕТ ПОМНИТЬ!, что полученный при отгонке головных фракций дистиллят не является пищевым продуктом, так как состоит, в основном, из эфиров, ацетонов, альдегидов и других ядовитых веществ, и может быть использован ТОЛЬКО для технических нужд, например, в качестве растворителя.
Г) Отбор фракции пищевого спирта.
Установим новую, чистую и большую по объему приемную емкость. Увеличим отбор до Еном, который сохранится до конца всего процесса ректификации. Проверим этот отбор с помощью секундомера и мерного цилиндра. Через 5-10мин проконтролируем показания термометра. Если все было сделано правильно, то показания термометра не изменятся. Причем эта температура останется неизменной в течение всего периода отбора пищевой фракции. Получаемый с этого момента СР является высококачественным пищевым продуктом. Однако, его состав (неотличимый многими даже по запаху) постепенно меняется и может быть разделен на три части:
- первые 5% общего объёма СР еще будут содержать в себе следы головных фракций
- центральная часть — порядка 80% общего объёма СР будут абсолютно чистыми
- и 5% общего объёма СР перед окончанием этого режима начнут приобретать следы хвостовых.Учитывая последнее замечание, можно рекомендовать для отбора пищевой фракции приготовить две отдельные помеченные ёмкости, которые использовать для отбора первой 10% -ой и последней 10%-ой порции СР.
При получении центральной части СР можно подобрать максимальный отбор Еmax (флегмовое число близко к V=2,5). Значение Еmax в основном зависит от качества перерабатываемого СС, поэтому требуется его уточнение при каждой ректификации. Однако, поиск и уточнение его можно рекомендовать только после полного освоения процесса ректификации по данной инструкции. Для нахождения Еmax необходимо пользоваться вторым вариантом правила отбора. Но помните — чем меньше отбор тем выше качество!. На этом режиме ректификации не требуется постоянного присутствия около аппарата, а приемные емкости заменяются по мере их наполнения. При получении третьей части пищевого СР рекомендуется пользоваться промежуточной емкостью, из которой периодически, предварительно убедившись в соответствии показания термометра температуре кипения СР, переливать спирт в основную емкость. Такой прием позволяет в случае, если будет упущен момент повышения температуры (поступление СР с большей концентрацией тяжелых спиртов и сивушных масел), не допустить попадания “плохого” спирта в “хороший”. Отбор СР завершается при достижении температуры на 0,1…0,05˚С выше температуры tс. Условно считается, что количество тяжелокипящих примесей, находящихся в этот момент в СР и вызывающих такое повышение температуры кипения, соответствует допустимым пищевым нормам. Приближение и окончание этого момента
Теоретические основы хроматографии
Известно несколько теорий хроматографического процесса. Существенное значение имеют метод теоретических тарелок (классическая теория) и кинетическая теория.
Теория теоретических тарелок (введена Мартином и Сингом Нобелевские лауреаты 1952 г.) основана на допущениях:
1) колонка состоит из определенного числа теоретических тарелок;
2) на каждой тарелке мгновенно достигается равновесие (равновесное отношение доли сорбированного вещества к доле, оставшейся в подвижной фазе), причем до того, как подвижная фаза переместится на следующую тарелку;
3) вводимая проба должна быть малой и обеспечивать линейную изотерму сорбции;
4)все протекающие в колонке процессы рассматриваются как взаимозависимые.
Теоретическая тарелка – это гипотетическая зона, высота которой соответствует достижению равновесия между двумя фазами. Чем больше теоретических тарелок в колонке, чем большее число раз устанавливается равновесие , тем эффективнее колонка.
Количественной мерой эффективности колонки служат вы
сота
Н, эквивалентная теоретической тарелке, (ВЭТТ), и число теоретических тарелок N.
Число теоретических тарелок легко рассчитать непосредственно из хроматограммы, сравнивая ширину пика и время пребывания компонента в колонке.
Ширину пика в этом случае измеряют в основании пика. Но это неудобно, так как нужно проводить касательные точно к сторонам пика Поэтому на практике наибольшее применение нашла следующая формула:
Где ω0,5 –
ширина пика на половине высоты
.
Высота,эквивалентная теоретической тарелке Н
измеряется в мм и определяется по формуле
Эффективность колонки тем выше, чем меньше высота, эквивалентная теоретической тарелке, и больше число теоретических тарелок.
Значения ВЭТТ и числа тарелок сохраняют свое значение и в кинетической теории хроматографии, учитывающей скорость миграции вещества, диффузию и другие факторы.
ВЭТТ, связана со скоростью потока уравнением Ван-Деемтера:
где А, В, С
–константы;
U
– скорость подвижной фазы.
Константа A
связана с действием вихревой диффузии, которая зависит от размера частиц и плотности заполнения колонки.
Величина В
связана с коэффициентом диффузии молекул в подвижной фазе, это слагаемое учитывает действие продольной диффузии.
Величина С
характеризует кинетику процесса сорбция-десорбция, массопередачу и другие эффекты.
Влияние каждого слагаемого уравнения навеличину Н
в зависимости от скорости подвижной фазы показано на рисунке:
-первое слагаемое дает постоянный вклад в Н;
-вклад второго слагаемого существен при небольшой скорости потока;
-с увеличением скорости подвижной фазы влияние третьего слагаемого возрастает, а доля второго уменьшается.
Суммарная кривая, характеризующая зависимость Н от скорости потока, представляет собой гиперболу.
| Поскольку эффективность колонки тем выше, чем меньше высота, эквивалентная теоретической тарелке, оптимальная скорость подвижной фазы будет равна скорости, соответствующей точке минимума этой кривой. |
Зависимость ВЭТТ от скорости подвижной фазы.
Теории хроматографического разделения
При хроматографировании происходят два процесса: разделение веществ и размывание хроматографических зон разделяемых веществ. Хроматографический процесс заключается в многократном повторении актов сорбции и десорбции. Поскольку скорость сорбции и десорбции для молекул различных веществ различна, то после повторения большого числа элементарных актов хроматографического разделения при прохождении смеси веществ через слой сорбента происходит разделение её на отдельные компоненты. Положение и вид хроматографических зон разделяемых веществ зависят от формы изотермы сорбции, скорости установления равновесия, степени диффузии вещества в подвижной фазе.
Изотермой сорбции называется зависимость концентрации вещества, сорбированного неподвижной фазой, от его концентрации в подвижной фазе при постоянной температуре. Если изотерма сорбции линейна, установление равновесия происходит мгновенно и степень диффузии вещества в подвижной фазе пренебрежимо мала, идеальный хроматографический пик описывается кривой нормального распределения.
Для объяснения причин размывания хроматографических зон используются две теории: теоретических тарелок и кинетическая теория.
Теория теоретических тарелок предполагает, что:
· каждая хроматографическая колонка состоит из некоторого количества одинаковых по величине абстрактных узких слоёв, называемых теоретическими тарелками, на каждой тарелке происходит один элементарный акт сорбции-десорбции;
· на каждой тарелке происходит мгновенное установление равновесия между веществом, находящимся в подвижной и неподвижной фазе;
· переход вещества с одной тарелки на другую происходит дискретно — при попадании на тарелку новой порции элюента равновесие нарушается, и часть вещества мгновенно переносится на следующую тарелку, где вновь мгновенно наступает равновесие и т.д.;
· на любой тарелке в любой момент времени число сорбируемых частиц вещества значительно больше числа сорбируемых частиц растворителя, изотерма сорбции является линейной.
Количественной характеристикой хроматографической колонки являются: высота эквивалентная теоретической тарелке (H) и число теоретических тарелок(N).
Высота эквивалентная теоретической тарелке представляет собой дисперсию, приходящуюся на единицу длины колонки. Чем меньше H и больше N, тем в меньшей степени происходит размывание пика и тем эффективнее хроматографическое разделение (рис. 22.4).
Рис. 22.4. Хроматограммы вещества X, полученные на колонках с различной эффективностью (
размерность оси абсцисс одинакова)
Число теоретических тарелок можно рассчитать:
где tR
— время удерживания,
kx
— коэффициент, величина которого зависит того, на каком уровне измеряется ширина пика
wx
.
Если пик представляет собой кривую нормального распределения, то ширина пика у основания равна 4s, на половине высоты — 2,35s, на 60,7% высоты (между точками перегиба) — 2s (рис. 22.5) и т.д. При измерении ширины пика у основания коэффициент kx будет равен 16 (42), на половине высоты — 5,54 (2,352) и т.д.
Рис. 22.5. Свойства идеального хроматографического пика
Число теоретических тарелок является мерой эффективности колонки и обычно постоянно для всех пиков на хроматограмме. Так как N является постоянной величиной, то при увеличении времени удерживания ширина пика увеличивается.
Согласно кинетической теории хроматографии размывание хроматографических пиков обусловлено одновременным действием трёх независимых друг от друга процессов:
Суммарное влияние вихревой диффузии, продольной диффузии и сопротивления массопереносу на величину высоты эквивалентной теоретической тарелке описывается уравнением Ван-Деемтера.
где U
— линейная скорость подвижной фазы
Рис. 22.6. Зависимость H от линейной скорости газа-носителя
Зависимость H от U для газовой хроматографии (насадочная колонка) показана на рис. 22.6. Оптимальную скорость газа-носителя, при которой величина Н минимальна, можно рассчитать по формуле:
В жидкостной хроматографии величина B практически не вносит вклад в размывание хроматографического пика (вязкость жидкости значительно больше вязкости газа), поэтому зависимость Н от U выглядит по-другому (как?).
Для характеристики эффективности разделения компонентов смеси, используют коэффициент разделения (a) и разрешение (RS).
Коэффициент разделения равен отношению исправленных времён удерживания (а также , , D) веществ:
Если a = 1, то разделение невозможно.
Разрешение рассчитывается по следующей формуле:
Разделение двух пиков считается полным, если RS ³ 1,5 (при RS = 1,5 расстояние между максимумами пиков составляет 6s, степень перекрывания пиков 0,13%) — рис. 22.6.
Рис. 22.6. Перекрывание пиков при различной величине RS
Число теоретических тарелок, необходимое для разделения с заданным разрешением, равно: